|
Präinvasive genitale Läsionen mit erheblich angestiegener Inzidenzrate | |||||
|
Ähnlich der zervikalen intraepithelialen Neoplasie wurde auch die VIN anhand der Ausbreitung proliferativer atypischer Zellen in drei Subtypen (Grad 1 bis 3) eingeteilt (Tabelle).
Da sich im morphologischen Spektrum von VIN 1-3 kein biologisches Kontinuum widerspiegelt, und VIN 1 kein Vorläufer eines Vulvakarzinoms
Die klassische VIN (engl.: usual VIN [uVIN]) ist mit 90 bis 98% die häufigste Form. In ihr lassen sich in neun von zehn Fällen Hochrisiko-HPV nachweisen. Betroffen sind weit überwiegend jüngere Frauen. Die differenzierte VIN (engl.: differentiated VIN [dVIN]) kommt vorwiegend bei postmenopausalen Frauen vor. Diese Form steht nicht im Zusammenhang mit einer HPV-Infektion. Die Diagnose der differenzierten VIN erfolgt vielfach in Verbindung mit einem invasiven Plattenepithelkarzinom der Vulva wie auch in Arealen mit Lichen sclerosus oder Lichen planus.
Vulväre intraepitheliale Neoplasie gilt als Präkanzerose, obgleich sie nur bei etwa 4% der behandelten Patientinnen in ein
invasives Vulvakarzinom übergeht. Untersuchungen an kleinen Fallzahlen zeigen jedoch, dass dieses Risiko bei unbehandelten VIN
ungleich höher ist. Das verdeutlicht die Notwendigkeit der frühzeitigen Diagnose und angemessenen Therapie. Aufgrund des gegenüber
der klassischen VIN erheblich höheren malignen Potenzials der differenzierten VIN ist die Unterscheidung beider Subtypen von besonderer
Wichtigkeit.
Klassische VIN Aus histopathologischer Sicht lassen sich warzige, basaloide und gemischte Typen unterscheiden. Für den warzigen Typ ist ein kondylomatöses Erscheinungsbild charakteristisch. Häufig werden Koilozyten, mehrkernige Zellen, mitotische Anomalien und Akanthose vorgefunden. Beim basaloiden Typ ist das Epithel verdickt und die Oberfläche erscheint flach und nicht-papillomatös. Relativ einheitlich undifferenzierte basaloide Zellen durchsetzen die gesamte Epidermis. Gemischte warzig/basaloide Formen kommen oft in derselben Läsion vor.
Immunhistologische Untersuchungen zur Expression von Galektin-1 in benignem Vulvaepithel, verschiedenen VIN-Stadien
und invasivem Plattenepithelkarzinom der Vulva erbrachten mit zunehmendem histopathologischem Grad des Epithels
eine ansteigende Expressionsrate des Beta-Galaktosid-bindenden Proteins auf Stromazellen in unmittelbarer Nachbarschaft
zu neoplastischen Zellen. Die Autoren sehen hierin eine mögliche Verbindung zur Progression der vulvären
Neoplasie [3]. Galektin-1 steht im Zusammenhang mit pathologischen Prozessen wie unter anderem
Tumorprogression, Krebszellinvasion und Metastasierung. In einer vergleichenden Untersuchung des DNA-Gehalts in normalem Vulva-epithel, Lichen sclerosus, differenzierter VIN und invasivem Plattenepithelkarzinom erwiesen sich 38% der dVIN-Proben als aneuploid oder tetraploid. Bei den Plattenepithelkarzinomen waren es sogar 65%. Bei Messungen an dVIN, die an ein Plattenepithelkarzinom angrenzten, überschritt der Ploidiestatus des dVIN niemals den des Karzinoms. Ferner wurde eine deutliche Korrelation zwischen Aneuploidie und einer hohen Expressionsrate des p53-Tumorsuppressorproteins registriert. Diese Korrelation zeigte sich auch bei sukzessiven zytometrischen Messungen von DNA-Gehalt und p53 in einzelnen Zellen [4]. Die Autoren schließen aus den Ploidiebefunden auf ein höheres malignes Potenzial von dVIN gegenüber Lichen sclerosus, so dass erstere mit höherer Wahrscheinlichkeit als Vorstufe des Plattenepithelkarzinoms in Frage kommt.
Bei der Analyse der entzündlichen Reaktion in Lichen sclerosus und dVIN – vermutlichen Vorstufen eines Platten-epithelkarzinoms
der Vulva – wurden nur in dVIN reichlich intraepitheliale Mastzellen nachgewiesen. Deren Degranulierung bestätigte sich bei
elektronenmikroskopischen Untersuchungen. Intraepitheliale Mastzellen können demnach auch zur Identifizierung von dVIN
herangezogen werden. Sie spielen vermutlich eine Rolle bei der Progression von dVIN zum invasiven Plattenepithelkarzinom
der Vulva [5].
Das klinische Erscheinungsbild der VIN ist sehr heterogen: Flache oder erhabene Erosionen der Haut können weißlich, rötlich oder pigmentiert erscheinen. Auch die Bildung von Ulzera ist möglich. Meist treten Symptome wie Pruritus oder Schmerzen auf, doch vielfach sind die Vulvaläsionen auch symptomlos. Zur Absicherung der Verdachtsdiagnose ist eine Biopsie unter Lokalanästhesie erforderlich. Operative Exzision der Läsionen Angesichts des prämalignen Charakters von VIN galt in der Vergangenheit die Vulvektomie – vielfach die radikale Vulvektomie – als erste therapeutische Wahl. Die Operationsränder sind hierbei oft positiv und die Rezidivrate hoch. In jüngerer Zeit beschränkt man sich bei der operativen Exzision weitgehend auf sichtbare Läsionen, um ein entstellendes Operationsergebnis möglicht vermeiden zu können. Zudem wird bei klassischem VIN vielfach konservativen Therapieformen der Vorzug gegeben. Die radikale Exzision der Läsionen wird aber bei differenzierter VIN weiterhin als notwendig erachtet. Medikamentöse Behandlung Hinsichtlich des Erhalts der vulvären Anatomie und Funktion erweist sich die medikamentöse Therapie der VIN als vorteilhaft. Hierdurch lassen sich insbesondere psychosexuelle Aspekte bei den vorwiegend jüngeren Patientinnen berücksichtigen. Mit 5%iger Imiquimod-Creme wird eine Immunmodulation bewirkt, bei der dendritische Zellen der Haut durch Aktivierung des Toll-ähnlichen Rezeptors TLR-7 zur Sekretion pro-inflammatorischer Zytokine veranlasst werden. Mit der Imiquimod-Therapie 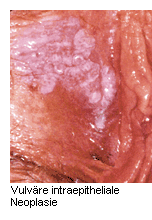 ließ sich das Rezidivrisiko gegenüber der operativen Behandlung deutlich verringern. In einem Vergleich von Imiquimod-behandelten
Patientinnen mit älteren Daten von operativ versorgten Patientinnen betrugen die Rezidivraten nach 16-monatigem Follow-up
20,5% bzw. 53,5% [6].
ließ sich das Rezidivrisiko gegenüber der operativen Behandlung deutlich verringern. In einem Vergleich von Imiquimod-behandelten
Patientinnen mit älteren Daten von operativ versorgten Patientinnen betrugen die Rezidivraten nach 16-monatigem Follow-up
20,5% bzw. 53,5% [6].Therapeutische Vakzine In mehr als 75% aller Fälle von VIN ist HPV 16 involviert. Hiezu trägt die hohe Expressionsrate der viralen Onkoproteine E6 und E7 durch infizierte Epithelzellen erheblich bei. Virus-spezifische T-Zellen, die gegen die viralen Onkoproteine gerichtet sind (Interferon-produzierende CD4+ und zytotoxische CD8+ T-Zellen), finden sich im Blut von Patientinnen mit hochgradiger VIN allenfalls in geringer Zahl. Diese Unzulänglichkeit des Immunsystems lässt sich durch Vakzination mit synthetisch hergestelltem Fusionsprotein von E6 und E7 überwinden. Bei Patientinnen mit histologisch bestätigter, HPV-16-positiver, hochgradiger VIN untersuchten niederländische Kliniker die Immunogenität und Wirksamkeit einer therapeutischen Vakzination mit drei oder vier Dosen eines Gemischs der vollständigen Peptidsequenz aus den viralen Onkoproteinen E6 und E7 von HPV 16. In allen Fällen kam es zu einer Vermehrung Virus-spezifischer T-Lymphozyten. Drei Monate nach der letzen Impfung wurde bei 60% der Patientinnen ein klinisches Ansprechen und eine Besserung der Symptome registriert. Fünf Frauen hatten eine Komplettremission der Läsionen, und bei vier von ihnen war HPV 16 nicht mehr #nachweisbar. Nach einem Jahr betrug die Ansprechrate 79%, wobei in 47% der Fälle ein Komplettansprechen zu verzeichnen war. [7]. In einer nachfolgenden Publikation berichtet die Arbeitsgruppe, dass bei Patientinnen mit kleineren vulvären Läsionen ein stärker ausgeprägtes HPV-16-spezifisches proliferatives Ansprechen beobachtet wird als bei Patientinnen mit größeren Läsionen. Insbesondere treten erheblich höhere Spiegel an Interferon- auf. Allerdings kann auch bei Patientinnen mit größeren Läsionen nicht von einem Immunversagen ausgegangen werden, da sich bei der Immunität von T-Gedächtniszellen kein Unterschied bei größeren und kleineren Läsionen feststellen ließ [8].
In einer klinischen Phase-II-Studie wurden VIN-Patientinnen acht Wochen lang mit dem topischen Immunmodulator Imiquimod und
anschließend im Abstand von vier Wochen mit drei Dosen der therapeutischen HPV-Vakzine TA-CIN (Fusionsprotein HPV 16 E6E7L2)
behandelt. Bei histologischen HPV-Tests in Biopsien nach 10, 20 und 52 Wochen wurde in 32%, 58% bzw. 63% der Fälle eine
Komplettremission der VIN beobachtet. Ein Jahr nach Behandlungsbeginn waren 36% der Läsionen frei von HPV 16 und 59% der
Patientinnen waren beschwerdefrei. Bei Frauen mit Ansprechen auf die sukzessive Therapie mit Imiquimod und der Vakzine wurde
nach 20 Wochen eine signifikant erhöhte lokale Infiltration von CD8- und CD4-T-Zellen registriert [9]. Literatur: [1] Terlou A, Blok LJ, Helmerhorst TJM, van Beurden M, 2010. Premalignant epithelial disorders of the vulva: squamous vulvar intraepithelial neoplasia, vulvar Paget´s disease and melanoma in situ. Acta Obstet Gynecol Scand 89:741-748. [2] Sideri M, Jones RW, Wilkinson EJ, et al. 2005. Squamous vulvar intraepithelial neoplasia. 2004 modified terminology, ISSVD Vulvar Oncology Subcommittee. J Reprod Med 50:807-810. [3] Kohrenhagen N, Voelker HU, Kapp M, et al. 2010. The expression of galectin-1 in vulvar neoplasia. Anticancer Res 30:1547-1552. [4] van der Avoort IA, van de Nieuwenhof HP, Otte-Höller I, et al. 2010. High levels of p53 expression correlate with DNA aneuploidy in (pre)malignancies of the vulva. Hum Pathol [Epub ahead of print]. [5] van de Nieuwenhof HP, Hebeda KM, Bulten J, et al. 2010. Specific intraepithelial localization of mast cells in differentiated vulvar intraepithelial neoplasia and its possible contribution to vulvar aquamous cell carcinoma development. Histopathology [Epub ahead of print]. [6] Le T, Menard C, Hicks-Boucher W, et al. 2007. Final results of a phase 2 study using continuous 5 % Imiquimod cream application in the primary treatment of high-grade vulva intraepithelial neoplasia. Gynecol Oncol 106:579-584. [7] Kenter GG, Welters MJP, Valentijn ARPM, et al. 2009. Vaccination against HPV-16 oncoproteins for vulvar intraepithelial neoplasia. N Engl J Med 361:1838-1847. [8] Welters MJP, Kenter GG, de Vos van Steenwijk PJ, et al. 2010. Success or failure of vaccination for HPV 16-positive vulvar lesions correlates with kinetics and phenotype of induced T-cell responses. Proc Natl Acad Sci USA 107:11895-11899. [9] Daayana S, Elkord E, Winters U, et al. 2010. Phase II trial of imiquimod and HPV therapeutic vaccination in patients with vulval intraepithelial neoplasia. Br J Cancer 102:1129-1136. [10] Dillner J, Kjaer SK, Wheeler, et al. für die FUTURE I/II Study Group, 2010. Four year efficacy of prophylactic human papillomavirus quadrivalent vaccine against low grade cervical, vulvar, and vaginal intraepithelialneoplasia and anogenital warts: randomised controlled trial. BMJ doi:10.1136/bmj.c3493 | |||||
|
Vulväre intraepitheliale Neoplasie – Präinvasive genitale Läsionen mit erheblich angestiegener Inzidenzrate Schlüsselwörter: Vulväre intraepitheliale Neoplasie (VIN), Vulvakrebs, klassische VIN, differenzierte VIN, humane Papillomaviren (HPV), Imiquimod-Creme |
|||||
| |||||
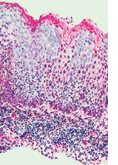
 ist, werden heute gemäß der International Society for the Study of Vulvar Disease (ISSVD) nur noch zwei Arten der VIN anhand der
Pathogenese und Morphologie unterschieden [2]:
ist, werden heute gemäß der International Society for the Study of Vulvar Disease (ISSVD) nur noch zwei Arten der VIN anhand der
Pathogenese und Morphologie unterschieden [2]: